Klar til metodevurdering av Alzheimersmedisin
Direktoratet for medisinske produkter sier de er klare til å starte metodevurderingen av Alzheimermedisinen lecanemab så snart produsenten har levert fullstendig dokumentasjon og relevante fageksperter er rekruttert.
Det fremgår av en oppdatering i saksdokumentene i Nye metoder.
Medisinen har gitt positive resultater ved å redusere plakk i hjernen ved tidlig Alzheimers sykdom.
Eisai og Biogens lecanemab, solgt under merkenavnet Leqembi, ble godkjent i USA i juli i fjor og er allerede i bruk der. Foreløpig har Leqembi ikke fått markedsføringstillatelse i Europa, men det europeiske legemiddelbyrået (EMA) vurderer for øyeblikket om legemidlet skal få slik tillatelse. I USA har Leqembi en listepris på om lag 26 500 dollar per år. Det er ennå ikke klart hva prisen blir i Europa.
Å spå utfallet i EMA er vanskelig, men de fleste tror medikamentet vil bli godkjent. Da følger Norge etter, har forskningssjef Geir Selbæk i Nasjonalt senter for Aldring og helse tidligere uttalt.
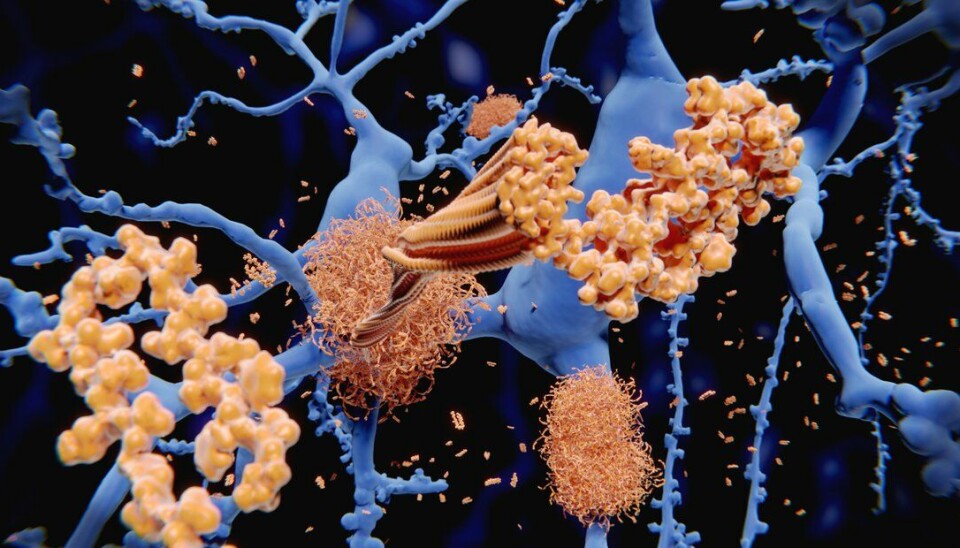
Til tross for at Lecanemab ikke representerer en kur for Alzheimers sykdom, indikerer en stor klinisk studie at legemidlet har merkbar positiv effekt på sykdomsforløpet. Lecanemab er er monoklonalt antistoff som binder til og eliminerer beta-amyloid fra sentralnervesystemet - et protein i hjernen som er antatt å være en utløsende faktor for Alzheimers sykdom. Behandlingen har i kliniske studier vist å bremse kognitiv og funksjonell tilbakegang hos pasienter i tidlig fase av Alzheimers med 27% sammenlignet med placebo gjennom en 18 måneders studieperiode. I tillegg førte medisinen til en dramatisk reduksjon i nivåene av beta-amyloid.
Lecanemab administreres intravenøst hver andre uke, hvilket krever at pasientene regelmessig besøker et sykehus eller en klinikk for å motta infusjonen.
Eisai og Biogen har begynt å sende inn data til FDA som kan gi en godkjenning av en månedlig vedlikeholdsdose som skal gis som en intravenøs infusjon, samt en ukentlig injiserbar versjon av Leqembi som pasienter kan motta hjemme.
Å få en markedsføringstillatelse i Europa representerer kun det innledende hinderet legemidlet må overvinne før det eventuelt kan tilbys norske pasienter kostnadsfritt på statlige sykehus. Etter en eventuell godkjennelse i EMA, må Beslutningsforum også gi sitt samtykke. I dette forumet treffer de fire direktørene i de regionale helseforetakene avgjørelser om hvorvidt behandlingens effekt vil rettferdiggjøre belastningen på de begrensede helsekronene.
Hovedtyngden i deres beslutning vil basere seg på en metodevurdering som er en helseøkonomisk analyse (kostnad-nytte-analyse). Nye metoder ønsket opprinnelig at det skulle gjennomføres en felles nordisk metodevurdering i regi Joint Nordic HTA-Bodies (tidligere FINOSE). Men det sa produsenten Eisai nei til. De ønsker i stedet at det gjøres nasjonale metodevurderinger i hver av de nordiske landene, og dette ønsket må de nasjonale legemiddelmyndighetene etterkomme.

Bestillerforum sier at de tar til etterretning at leverandør kommer til å levere til en nasjonal metodevurdering hos Direktoratet for medisinske produkter. Det vil også gjennomføres prisforhandlinger mellom produsenten og Sykehusinnkjøp.
Nylig har lecanemab fått konkurranse i USA etter at FDA i begynnelsen av av juli godkjente donanemab som er utviklet av Eli Lilly. I likhet med lecanemab er også dette et monoklonalt antistoff designet for å bremse progresjonen av tidlig Alzheimers sykdom.
Lilly opplyser at donanemab vil bli solgt under merkenavnet Kisunla og listeprisen vil være 695 dollar per hetteglass før rabatt. Det betyr at en seks måneders behandling vil beløpe seg til 12,522 dollar og 32,000 dollar for et år, avhengig av når pasienten fullfører behandlingen.
Dagens behandling i Norge
Legemiddelbehandlingen som i dag kan tilbys norske pasienter kan bedre noen av symptomene ved Alzheimer, men de har begrenset effekt på kognitiv funksjon, oppmerksomhet, initiativ og hukommelse hos noen av pasientene. De har ingen dokumentert effekt på mild kognitiv svikt og forsinker heller ikke utviklingen av demens.
De mest brukte er kolinesterasehemmerne Aricept (donepezil), Exelon (rivastigmin) og Reminyl (galantamin). De tre legemidlene anses å ha en lik klinisk effekt, men noe ulik bivirkningsprofil.
















